2022-02-15 10:43:06
최근 FDA의 마약 중심평가 및 연구 (신더)는 신약 리뷰에 관한 보고서를 발표했다.승인은 총 46 개의 신약을 승인했다 (그림 1).거의 10 년 동안 최고 높이. 2008 년부터 2017 년까지 신약의 수를 승인그림 2에 나와 있습니다.
그림 1.2017 년 Cder의 신약 승인 46 건
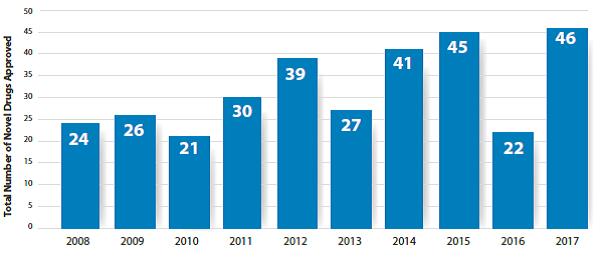
그림2. 2008 년부터 2017 년까지 신약 승인
승인 된 46 개의 신약 중 15 개(besponsa)를 포함한 총계의 33 %를 차지하는 1 등석이며,brineura, dupixent, emflaza, giapreza, hemlibra, idhifa, macrilen, mepsevii,ocrevus, prevymis, radicava, rhopressa, rydapt 및 xermelo; 고아 마약은18, 각각 aliqopa, alunbrig, austedo, bavencio, benznidazole, besponsa,brineura, calquence, emflaza, hemlibra, idhifa, macrilen, mepsevii, prevymis,radicava, rydapt xermelo 및 zejula.
질병 치료 분야에서 항암약품이 먼저 분류되며 총 12 개의 신약이 승인됩니다. 그들은 연분홍,verzenio, aliqopa, besponsa, inhifa, nerlynx, imfinzi, rydapat, alunbrig,zejula, bavencio 및 kisqali 각각; 소화기 및 신진 대사가 뒤 따른다.마약, 신경계 약물 및 전신 항 감염제, 숫자위의 질병에 대한 신약 승인 건수는 각각 5 건입니다.
시장에 관한, 분석가ouprex, ocrevus, ozempic, hemlibra 및 imfinzi가 무거워지기를 기대합니다.약 50 억 달러의 최고 판매액을 기록한 \"폭탄\"마약억 달러, 35 억 달러, 30 억 달러 및 25 억 달러 불화.
2017 년에 승인 된 신규약의 신청을 통해 fda 에의 한 약은 거의 10 년 최고를 명중했다혁신적인 방법으로 우선 순위 리뷰와 같은 신약 평가를 가속화하고,획기적인 치료법 및 빠른 치료법. 46 건의 신약 승인, 28 건의 약물우선 순위 검토를 통해 평가되었으며, 18 개의 약물은 빠른 추적으로 확인되었습니다그리고 획기적인 치료로 17 명이 확인되었습니다. 중국도 적극적으로신약 평가를 가속화하고 격려하기위한 정책 수립기업이 혁신적인 마약을 개발하여 우리나라를 수입 역할을하도록글로벌 r & 신약 마약.
참고:
건강 증진혁신 : 2017 년 신약 치료 승인 보고서
에 의해 편집 됨 소주 yacoo 과학 공동. 주식 회사 .
저작권 © Suzhou Yacoo Science Co., Ltd. 모든 권리 보유
온라인 서비스